依數性(Colligative Property)是指溶液所具有的一類性質,這類性質只取決於溶質和溶劑中分子的數量,而不取決於這些分子的性質。溶液的依數性包括:蒸氣壓降低、沸點上升、熔點下降以及滲透壓。通過測量稀的非離子水溶液(例如尿素或葡萄糖的水溶液)中的依數性,可以求得溶質的相對分子質量的精確值。另外,測量離子溶液的依數性則可以估計溶質電離的百分比。
沸點上升(英文: Boiling-point elevation)是描述非揮發性混合溶液的沸點會比非揮發性純溶劑得沸點還要高的現象,也就是說,在非揮發性溶劑中加入非揮發性溶質,其會產生沸點變化量。沸點上升現象可以用沸點上升測定法(英文: ebullioscopy;希臘文:ζεσεοσκοπία,意旨”沸點觀測”)來量測。
一般在定量計算沸點上升率,會先假設溶液是屬於低濃度的非揮發性理想溶液,因此沸點上升率ΔTb會與溶質的重量莫耳濃度mB和溶液的粒子數目i成正比,即為:
ΔTb = Kb · mB · i
並定義沸點上升常數Kb,其與溶劑的蒸氣壓和分子量有關,和溶質無關。
詳細請參見依數性-沸點上升 http://skiedeager.pixnet.net/blog/post/35573670
熔點下降(英文:Freezing-point depression)是描述混合溶液的熔點或凝結點下降的現象,即該溶液的熔點介於兩純溶劑的熔點之間。在測定方面,可採用熔點下降測定法”(cryoscopy,希臘語: Κρυοσκοπία,意旨’冰點觀測’)來量測。

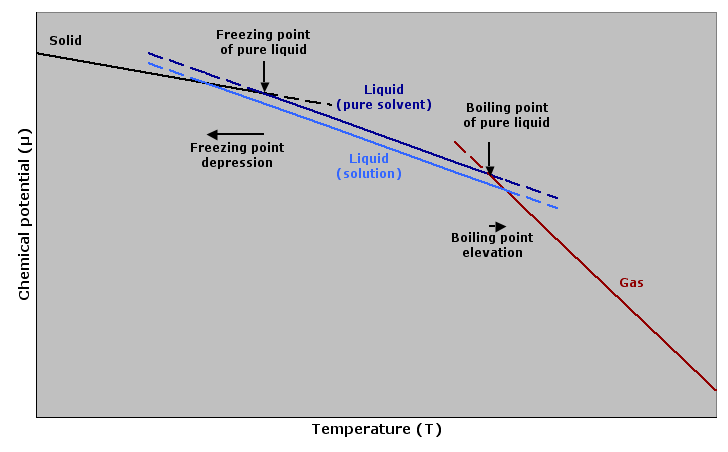 當溶質溶進溶液後,化學位能對溫度的趨勢圖可以解釋為什麼溶液會出現沸點上升現象。
當溶質溶進溶液後,化學位能對溫度的趨勢圖可以解釋為什麼溶液會出現沸點上升現象。 {{ article.title }}
{{ article.title }}

